|
|
O dióxido de carbono (CO2) é um gás incolor, inodoro, denso e pouco reativo, com o sabor picante, corrosivo na presença de umidade. Forma parte da troposfera (capa da atmosfera mais próxima da Terra), atualmente em uma proporção de 350 ppm (partes por milhão). Seu ciclo na natureza está vinculado ao do oxigênio.
O dióxido de carbono, ou anidrido carbônico é um composto químico constituído por dois átomos de oxigênio e um átomo de carbono. A representação química é CO2. O dióxido de carbono foi descoberto pelo escocês Joseph Black em 1754. É o principal composto dos gases vulcânicos expelidos durante a erupção.
Sem este gás a Terra seria um bloco de gelo. Por outro lado, um excesso de CO2 impede a saída de calor da atmosfera, provocando um aquecimento do planeta denominado efeito estufa.
Também conhecido como anidrido carbônico, o dióxido de carbono é o resultado da combinação de dois elementos químicos : o carbono (C) e o oxigênio (O2) , e sua representação química é CO2 , o que significa que a sua molécula é composta de um átomo de carbono para dois de oxigênio. É bom recordar que o O2 é uma molécula que contém dois átomos de oxigênio com a fórmula O ( cujo número atômico é 8 → 8 átomos e 8 prótons). Quando aparece em forma molecular, ou O2, o oxigênio se apresenta em forma gasosa e constitui 20% da atmosfera terrestre . É um dos elementos mais importantes da química orgânica, participando de maneira relevante no ciclo energético dos seres vivos, sendo essencial na respiração celular dos organismos aeróbicos, dentre os quais os mamíferos (em que os humanos são incluídos) e as plantas.
EXPIRAÇÃO DO GÁS DIÓXIDO DE CARBONO
Em cada dia, cada ser humano inspira 830g de O2 e expira 1140 g. de CO2 . Ou seja :na inspiração o animal absorve oxigênio e, na expiração, expele dióxido de carbono.
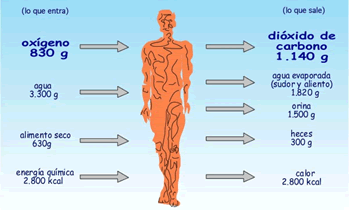 |
O que entra -
O que sai
www.urbanext.uiuc.edu/gpe_sp/images_rev/air.gif |
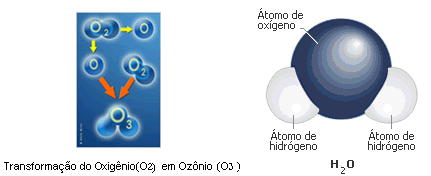
Existe, também, uma forma molecular constituída por três átomos de oxigênio, O3, denominada ozônio, cuja presença maior se encontra na estratosfera, onde se aglomera com outras idênticas, formando a ozonosfera - em condições de normalidade quantitativa, protege a Terra da incidência de radiação ultravioleta procedente do Sol, tornando-se, sua redução, letal aos seres vivos da superfície terrestre. Há uma terceira fórmula molecular, com apenas um átomo de oxigênio , chamado de oxigênio livre ou fenólico (O) . Este último pode resultar de uma carga elétrica recebida pela molécula O2 (com todas as suas camadas de elétrons completa), que a divide em duas moléculas de oxigênio, cada uma com sua última camada de elétrons incompleta, por isso necessitando juntar-se a outra proporcionalmente incompleta com suas mesmas características substanciais ou de substância diversa, para se completar - denomina-se oxigênio livre porque não sofreu união com outro átomo . É muito raro encontrar-se oxigênio livre na atmosfera, eis que cada um desses átomos está sempre se ligando a outros de sua mesma ou de outras características, compartilhando, assim, com a outra substância, pares de elétrons, para se tornarem estáveis e cumprirem suas funções na natureza.Através de “reações químicas”, naturais ou induzidas, é que se formam as moléculas das diversas substâncias, em que se ligam as últimas camadas de cada átomo livre com a de outro, na mesma condição, compartilhando, ambas, assim, pares de elétrons, transformando-se.Como no exemplo abaixo, em que a seta significa “transforma-se em”:
O2 + carga elétrica → O + O , que, por sua vez, podem formar duas moléculas de ozônio se se encontrarem com duas moléculas do O2 . Se o encontro for apenas com uma molécula do O2 , o Ozônio se completa apenas com um átomo de O e, o outro ,continuando livre e instável, procura se ligar imediatamente a outra substância, igualmente livre e instável , como o Hidrogênio , H (nesse caso há necessidade de dois átomos livres de Hidrogênio para aquele Oxigênio livre) o que vai resultar no conhecidíssimo composto água, monóxido de hidrogênio ou óxido de hidrogênio, cuja fórmula molecular é H2O {significado : uma molécula de água é composta por dois átomos de Hidrogênio (H) e um átomo de Oxigênio (O)}. Note-se que átomos de Hidrogênio livre e do Oxigênio livre são raros na atmosfera, pois na natureza estará sempre havendo reações químicas, por um motivo de uma força elétrica natural, ligando-se a outros átomos livres ou substâncias instáveis.
 |
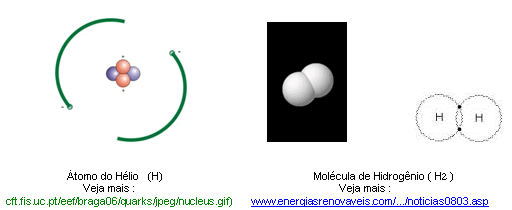
Nota 1 : O elemento Hidrogênio , em estado puro, com apenas um átomo , é uma substância denominada Hélio, muito rara em nossa atmosfera e muito freqüente na atmosfera solar, daí o seu nome. Na superfície de nosso planeta, é um gás fóssil encontrado em reservas naturais em determinados poços de extração de reservas petrolíferas, extremamente leve e volátil. Foi muito usado em combustíveis, especialmente dos dirigíveis e hoje se usa mais para obtenção de uma atmosfera inerte, então em estado líquido. De futuro, espera-se usá-lo bastante no arrefecimento de reatores atômicos. Não é saudável para a inalação humana. Quando o átomo do Hélio perde um elétron ,tornando-se livre, ele se liga imediatamente a outro na mesma situação – no caso do próprio Hidrogênio, forma a molécula H2.
 |
Nota 2 : Determinadas substâncias se transformam em outras através de Ligações. As ligações podem ser feitas de três formas :
a) metálicas (entre metais): em um composto de determinado metal, há tendência , em certas circunstâncias, de liberação de elétrons da ultima camada de cada átomo, fazendo uma cadeia de cátions , mergulhados em uma rede de elétrons – aplicado um campo elétrico sobre eles, cria-se uma corrente elétrica;
b) iônicas : no caso de metais com não metais e metais com hidrogênio; os átomos desses elementos trocam elétrons da última camada (eletrosfera) entre si, ficando o recebedor com mais “n” elétrons, do que o número de seus prótons e o doador com menos “n” elétrons do que os seus prótons, sempre um ganhando uma unidade eletrônica para cada uma que o outro perde,denominando-se, o primeiro, ânion e, o segundo, cátion. Sendo a perda e o ganho equivalentes, há equivalência de forças positiva e negativa - formando-se uma atração elétrica muito forte . (Fórmula Eletrônica de Lewis);
c) por compartilhamento,covalente (polar, simples,ou dativa). No caso do CO2 , há covalência dativa.Existe um elétron em excesso na última camada de um átomo livre (ânion) e em escassez em um outro (cátion) ;então, o átomo com mais elétrons do que prótons (eletronegativo ) permanece no mesmo local , criando uma polaridade na respectiva última camada (eletrosfera) , para onde se dirige o outro elemento, com menos elétrons do que prótons (eletropositivo) - a atração se dá em relação ao outro átomo inteiro, passando os elétrons excessivos a fazer parte integrante de ambas as últimas camadas (eletrosferas) de ambos os átomos , preenchendo-se mutuamente com os seus números corretos , dizendo-se que ficaram saturados. Mas se assim mesmo faltar ou sobrar mais de um elétron na(s) última(s) camada(s) (ou eletrosferas), o(s) átomo(s) ainda estará(ão) insaturado(s) e, por isso, pode(m) repetir a operação, ligando-se a outros inúmeros átomos livres de inúmeras substâncias, até que fiquem completamente saturados (ou melhor, que se completem as suas últimas camadas de elétrons, igualando-se o número total de prótons e de elétrons de cada átomo), formando verdadeiras cadeias.Quando há uma doação mútua de elétrons entre dois átomos, tem-se ligação covalente dativa como no CO2. Veja mais em : http://luizclaudionovaes.sites.uol.com.br/ligaquim.htm .
No caso do CO2, a direção da doação se dá do átomo mais eletronegativo, o do Oxigênio, que tem seis elétrons na última camada , para o menos eletronegativo, que possui ali 4 elétrons, ou seja, o Carbono.Contrariamente à regra, pois – mas o resultado, em caráter objetivo, da reação, não diverge do que ocorre ordinariamente, em sentido contrário. De acordo com o compartilhamento, todos ficam com 8 elétrons em cada última camada, cada um fornecendo à última camada do outro , 2 elétrons de sua última camada : nenhum deles perde, todos ganham e se saturam – cada átomo de Oxigênio ganha 2 elétrons e o átomo de Carbono ganha 4 elétrons, 2 de cada Oxigênio. Todos são, pois dependentes entre si, e, por isso, continuam ligados.
 |
O CO2 é , pois, uma substância estável, produto de reação em diferentes processos, tais como, a combustão do carvão e dos hidrocarbonetos, a fermentação dos líquidos e a respiração dos seres humanos e dos animais. Na atmosfera terrestre, onde também se encontra, o normal é que esteja em fraca concentração. Este gás é assimilado pelas plantas, que por seu turno operam uma reação química no seu interior, durante a qual se dá a quebra dessa molécula estável, com liberação de oxigênio (O2) e a retenção do Carbono. O CO2 gasoso tem um odor ligeiramente irritante, é incolor e mais pesado que o ar. Seu estado gasoso muda , quando a uma temperatura muito fria, a 78,5 ºC negativos, formando a chamada “neve carbônica” (nesse estado é muito instável para poder ser isolado facilmente). E, a temperaturas mais frias, ainda, passa a sólido, chamado de “gelo seco”.
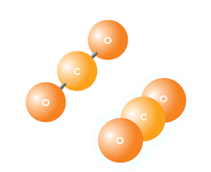 |
Representação da a molécula de CO2 ,onde C significa Carbono e, O, Oxigênio
Compõe-se de r dois átomos de Oxigênio insaturado e um de Carbono insaturado
Ver mais : www.carbonforce.net/public/index.php?option=c...
|
O CO2 é utilizado em bebidas carbonatadas, para dar-lhes efervescência.E em extintores durante os incêndios para isolar o oxigênio do combustível.
CICLO DO DIÓXIDO DE CARBONO NA SUPERFÍCIE TERRESTRE
|
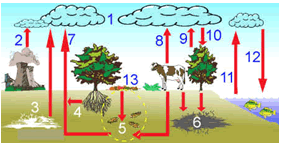 |
| 1- Carbono na atmosfera
2-Fábricas/centrais térmicas,
3-Depósito localizado
4-Respiração das raízes
5-Decomposição
6-Depósito de combustíveis fósseis (carvão, petróleo, gás natural ...)
7-Emissão do solo e respiração dos organismos
8-Respiração dos animais terrestres (seres humanos incluídos)
9- Respiração das plantas
10- Assimilação pelas plantas
11- Respiração das algas e animais aquáticos
12-Fotossíntese das algas 13-Restos vegetais .
www.natureduca.com/.../cienc_ciclo_carbono .jpg |
O oxigênio respirado pelos organismos aeróbicos, liberado pelas plantas no processo de fotossíntese, participa na conversão de nutrientes em energia intracelular.
A redução do nível de oxigênio provoca a hipoxemia e, a falta total ocasiona a anoxia, podendo provocar a morte do organismo.
A hemoglobina é o pigmento que dá a cor aos glóbulos vermelhos (eritrócitos) e tem a função vital de distribuir o oxigênio pelo organismo.
Veja mais :
http://pt.wikipedia.org/wiki/Oxig%C3%A9nio
http://luizclaudionovaes.sites.uol.com.br/ligaquim.htm
www.projeto-biologico.arizona.edu/.../09t2.gif
www.urbanext.uiuc.edu/gpe_sp/images_rev/air.gif
www.cricyt.edu.ar/.../images/dioxcarb.jpg
http://pt.wikipedia.org/wiki/Di%C3%B3xido_de_carbono
http://educar.sc.usp.br/licenciatura/2003/ee/Efeito_Estufa.html
http://noticias.pluc.com.br/showarticle.php?articleID=992
http://www.feiradeciencias.com.br/sala02/02_100.asp
www.juntadeandalucia.es/.../ver/09/fotosin.gif
www.somosamigosdelatierra.org/00_imagenes/inv...
www.corpohumano.hpg.ig.com.br/.../i_pulmones.jpg
|